Therapie des Morbus Crohn
Akuter Schub
Leichte bis moderate Aktivität
Die Therapie der Wahl ist in dieser Situation Budesonid in einer Dosierung von 9 mg pro Tag. Die Therapie muss beim typischen Ileozoekalbefall oral eingenommen werden; bei vorwiegender Entzündung im distalen Kolon kann Budesonid als Einlauf angewendet werden. Ein Versuch mit 5-ASA kann bei leichter Aktivität und vorwiegendem Kolonbefall die Symptomatik verbessern, der Therapieerfolg ist aber meist beschränkt. Budesonid ist effektiv und der Behandlung mit 5–ASA überlegen. Vorsicht bei eingeschränkter Leberfunktion, da der Budenosidabbau vermindert ist und die Serumspiegel dadurch steigen (hoher first-pass Effekt in der Leber).
Führt Budesonid nicht zur Remission, ist auf systemische Glukokortikoide umzusteigen. Gestartet werden soll mit einer Dosis von ca. 60 mg Prednison-Äquivalent. Beim moderat aktiven Morbus Crohn ist die Wirkung von Budesonid im Vergleich zu einer systemisch wirkenden Prednison-Therapie (1 mg/kg KG/Tag) geringer, es treten aber auch deutlich weniger Nebenwirkungen auf. Durch eine Prednison-Behandlung können die meisten Patienten innerhalb von 6 Wochen in eine Remission gebracht werden. Allerdings ist mit häufigeren Nebenwirkungen als unter Budesonid zu rechnen.
Starke Aktivität
Bei stark aktivem Morbus Crohn wird empfohlen, direkt mit systemischen Steroiden zu behandeln (ca. 60 mg Prednison-Äquivalent). Die Dauer sollte 3 Monate nicht überschreiten. Nach etwa einer Woche sollte eine deutliche Besserung der Symptome, nach 4-8 Wochen eine Remission eintreten. Das Ausschleichen der Steroide erfolgt individuell; ein zu frühes Absetzen ist wegen der Gefahr eines Frührezidivs zu vermeiden. Eine Nebenniereninsuffizienz kann durch schrittweise Reduktion verhindert werden.
Bei schwerer Krankheitsaktivität sollte die Steroid-Therapie frühzeitig durch eine immunsuppressive Therapie mit Azathioprin (Dosis 2-2.5 mg/kg Körpergewicht) bzw. 6-Mercapto-Purin (1-1.5 mg/kgKG) ergänzt werden. Unter den Purinanaloga müssen regelmässige Laborkontrollen erfolgen, da sich eine (gewollte) Lymphopenie bzw. eine Leukopenie entwickelt und zudem in etwa 3% der Fälle eine Hepatitis und in 3% eine Pankreatitis auftreten kann. Alternativ oder bei Unverträglichkeiten kann Methotrexat eingesetzt werden. Spricht die Krankheit nicht auf diese Therapien an, ist der Einsatz von TNF-Antagonisten indiziert, falls keine Operationsindikation vorliegt. In gewissen Situationen können bei Persistenz der hohen Krankheitsaktivität trotz adäquater Steroiddosis oder bei Kontraindikationen für Glukokortikoide anti-TNF-α-Antikörper vor den Immunsuppressiva eingesetzt werden. Drei verschiedene anti-TNF-α-Antikörper stehen in der Schweiz zur Verfügung: Infliximab als Infusionsbehandlung ist in einer Dosierung von 5 mg/kgKG iv in den Wochen 0, 2 und 6 zu verabreichen zur Remissionsinduktion; anschliessend sollte alle 8 Wochen eine Infusion verabreicht werden. Alternativ stehen Certolizumab (Induktionstherapie mit 400 mg sc in den Wochen 0, 2 und 4, anschliessend 400 mg sc. alle 4 Wochen) oder Adalimumab (Induktionstherapie mit 160 mg sc in der ersten Woche, 80 mg sc nach weiteren 2 Wochen, dann 40 mg sc alle 2 Wochen) zur Verfügung.
Antibiotika (vorzugsweise Fluoroquinolone und Metronidazol) sind indiziert, wenn infektiöse Komplikationen (Abszesse, infizierte Fisteln, …) vorliegen.
Chronisch aktiver oder chronisch rezidivierender Verlauf
Chronisch aktive oder remittierende Verläufe werden auch als Steroid-refraktär (nicht auf Steroide ansprechend) respektive Steroid-abhängig (Rezidiv nach Absetzen der Steroide) bezeichnet.
Die Therapie der Wahl sind Immunsuppressiva (Azathioprin bzw. Mercaptopurin, siehe oben) oder TNF-α-Hemmer (Infliximab alle 8 Wochen iv, Certolizumab alle 4 Wochen sc, Adalimumab alle 2 Wochen sc) über Jahre. Eine Alternative dazu ist Methotrexat (25 mg pro Woche sc, im oder iv).
TNF-Hemmer ermöglichen eine schnelle Besserung der Symptome, bei den Immunsuppressiva ist mit einer Verzögerung des Wirkungseintritts um 6-12 Wochen zu rechnen. Die kontinuierliche Gabe von TNF-Hemmern ist der episodischen Verabreichung vorzuziehen. Die Therapie mit TNF-Hemmern ist deshalb vor allem eine Option bei therapierefraktärem Verlauf.
Zurzeit wird der Benefit durch eine Kombination von Azathioprin mit TNF-Hemmern untersucht. Erste Resultate suggerieren, dass die Effektivität der Kombination bei frühem Einsatz höher ist, als wenn zuerst mit Immunsuppressiva vorbehandelt wird.
Vor dem Beginn mit einem TNF-Hemmer sind folgende Abklärungen notwendig:
- Anamnese bezüglich Herzinsuffizienz (Kontraindikation für TNF-Hemmer bei NYHA III und IV HI), chronischer Lebererkrankung, neurologischer Erkrankungen und Neoplasien, vor allem Lymphomen (mit Vorsicht einzusetzen)
- Ausschluss einer aktiven Tuberkulose (Anamnese, Röntgen, Quantiferontest oder T-SPOT)
- Ausschluss von Hepatitis B, HIV und Bestimmung der Transaminasen
Patienten profitieren von Biologika (anti-TNF-α-Antikörpern) in folgenden Situationen:
- Steroidabhängigkeit (mehr als eine akute Steroid-bedürftige Episode pro Jahr)
- Resistenz auf Steroide oder Azathioprin
- Akuter Schub unter Immunsuppression mit Azathioprin oder 6-MP
- Steroid- oder Azathioprinnebenwirkungen
Diese Situationen bewirken meistens eine Minderung der Lebensqualität durch persistierende Symptome, drainierende Fisteln, extraintestinale Symptome oder rezidivierende Hospitalisationen respektive Operationen.
Illustration des Therapieeffektes auf die Darmschleimhaut:
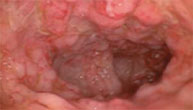 |
|
vor Therapie | |
 |
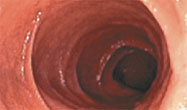 |
|
nach Therapie | |
Remissionserhaltung
Eine Remission besteht, wenn keine klinischen Zeichen einer Krankheitsaktivität, keine Symptome oder ein Crohn’s Disease Activity Index < 150 vorliegen. Nach Erreichen einer Remission besteht grundsätzlich das Risiko eines erneuten Schubes. Dieses Risiko ist für den einzelnen Patienten nicht abzuschätzen. In klinischen Studien zeigte sich eine Rezidivhäufigkeit im ersten Jahr zwischen 30 und 60% und im zweiten Jahr zwischen 40 und 70% der betroffenen Patienten. Ziel einer Langzeittherapie sollte die Erhaltung einer Remission sein.
Nach einem ersten leichten oder moderaten Krankheitsschub ist es gerechtfertigt, auf eine remissionserhaltende Therapie vorderhand zu verzichten. Erleidet ein Patient jedoch ein Rezidiv, kann eine Initiierung einer remissionserhaltenden Therapie erwogen werden. Bei schwerem oder kompliziertem Krankheitsverlauf sollten Nutzen und Risiken einer remissionserhaltenden Therapie oder einer Operation gegeneinander abgewogen werden. Grundsätzlich ist aber eine Erhaltungstherapie bei diesen Patienten sinnvoll. Die Erhaltungstherapie muss in der Regel über Jahre aufrechterhalten werden. Dies gilt für Immunsuppressiva und Biologika, nicht jedoch für Glukokortikoide. Bei letzteren ist auf eine Langzeitanwendung unbedingt zu verzichten, da für Steroide keine remissionserhaltende Wirkung nachgewiesen werden konnte.
Patienten mit Morbus Crohn sollten dringlichst dazu angehalten werden, einen allfälligen Nikotinkonsum zu sistieren; die Rezidivrate kann durch den Verzicht aufs Rauchen ungefähr halbiert werden.
Eine generelle Indikation zur postoperativen medikamentösen Therapie besteht nicht. Nach operativer Erzielung einer Remission ist eine remissionserhaltende Therapie mit Immunsuppressiva oder Biologika dann indiziert, wenn der Verlauf der Erkrankung bereits vor dem Eingriff komplex war oder eine Steroidabhängigkeit bestand.
| |
| Mediscope |
| |
| 23.02.2010 - dde |
| |
 |
|